Saviez-vous la réaction du Saint Graal en chimie?
April 22, 2024
En ce qui concerne le gaz naturel, vous ne devez pas vous être familier, et de nos jours, aucun ménage ne peut cuire sans lui. Le composant principal du gaz naturel est le méthane, qui est l'un des composés d'hydrocarbures les plus simples. Accélérer le développement et l'utilisation du méthane est la clé pour réaliser le développement vert et durable de l'industrie énergétique et chimique. En plus de son utilisation directe comme combustible, le méthane peut également être utilisé comme ressource C1, c'est-à-dire une molécule qui contient un atome de carbone et peut continuer à être convertie pour préparer des produits chimiques à haute valeur ajoutée, tels que le méthanol, la forme formique acide et ainsi de suite. Le méthane peut être brûlé dans l'oxygène pour former l'eau et le dioxyde de carbone. Sans combustion, est-il possible d'activer et de convertir les liaisons hydrocarbures des molécules de méthane dans des conditions douces? La réponse est oui! Il s'agit de la réaction du "Saint Graal" dans le domaine de la catalyse. Les réactions associées au «Saint Graal» sont souvent extrêmement difficiles, car elles peuvent avoir besoin d'être effectuées dans des conditions très difficiles, ou ils peuvent avoir besoin de surmonter les difficultés inhérentes à une réaction chimique, comme l'activation de composés très stables, faibles rendements et faible sélectivité. Ces défis rendent difficile de réaliser ces réactions, mais si elles peuvent être réalisées avec succès, elles entraîneront des percées importantes dans la recherche scientifique et les applications industrielles.

1.Challenge dans la conversion du méthane à basse température Il est très difficile de convertir le méthane directement en d'autres produits chimiques utiles avec de l'oxygène bon marché à basse température ou même à température ambiante, pourquoi? Regardons la nature du méthane et de l'oxygène. La structure chimique du méthane contient quatre liaisons hydrogène carbone identiques (CH) qui forment une configuration orthotétraédrique hautement symétrique, et chaque liaison CH3-H de méthane a une énergie de liaison allant jusqu'à 435 kJ / mol. Nous pouvons considérer la liaison CH du méthane comme un printemps particulièrement fort. Ce printemps est très tendu et nécessite beaucoup de force pour s'étirer. En chimie, cette "force" est l'énergie nécessaire pour briser la liaison CH. Cette énergie de liaison élevée rend les liaisons CH du méthane thermodynamiquement stables et très difficiles à décomposer ou à réagir dans des conditions normales. En revanche, dans les réactions chimiques, les groupes réactifs sont généralement générés par interaction polaire (l'interaction polaire est le phénomène qu'une molécule a une extrémité chargée positivement et l'autre chargée négativement), tandis que la structure symétrique et la nature non polaire de la molécule de méthane empêche Il en générant une telle polarité (selon la configuration moléculaire, une molécule avec un plan de symétrie n'a pas de polarité) et ne peut pas fournir de groupes réactifs. Par conséquent, l'activation et la conversion du méthane sont très difficiles et nécessitent généralement des conditions difficiles telles que des températures élevées (600-1100 ° C) ou des "extrémophiles" tels que les acides super forts et les radicaux libres pour aider à l'activation du méthane. Par conséquent, la principale difficulté de réaliser l'activation à basse température du méthane et de l'oxygène réside dans la façon d'activer la liaison CH du méthane, c'est-à-dire comment étirer le "ressort" dans la liaison CH. 2.Le miracle du catalyseur Les scientifiques ont trouvé une bonne solution à ce problème et ont choisi d'utiliser un catalyseur pour aider à activer le méthane à basse température (un catalyseur est un produit chimique qui ne change pas avant ou après une réaction, mais accélère la réaction en modifiant la quantité minimale d'énergie qui doit être injectée pour que la réaction ait lieu). En 2023, le journal Nature Catalysis a rapporté sur le processus de réalisation de la conversion directe du méthane avec l'oxygène en oxydes C1 (méthanol (CH3OH), acide formique (HCOOH) et méthylène glycol (HOCH2OH)) en utilisant un disulfure de molybdène spécifique (MOS2) Catalyseur à 25 ° C. Une conversion de méthane de 4,2% et près de 100% d'oxygénate C1 a été obtenue en transformant le méthane et l'oxygène en oxygénates C1 précieuses dans des conditions ambiantes. Ce MOS2 est le seul catalyseur rapporté jusqu'à présent qui peut réaliser la conversion de la température ambiante du méthane et de l'oxygène. Tout cela est dû à la géométrie unique et à la structure électronique du site MO sur le bord du MOS2. Ce site MO a une activité d'activation élevée vers l'oxygène dans un environnement aqueux, formant les espèces magiques O = MO = O *. Cette espèce rend la liaison carbone-hydrogène plus facile à briser et réduit l'énergie d'activation de la liaison CH du méthane, augmentant ainsi considérablement la réactivité du méthane, et réalisant ainsi l'activation à basse température du méthane et de l'oxygène. Cette découverte apportera plus de possibilités pour l'utilisation future de l'énergie et la protection de l'environnement, tout en nous donnant une compréhension plus approfondie du rôle incroyable des catalyseurs et des auxiliaires.
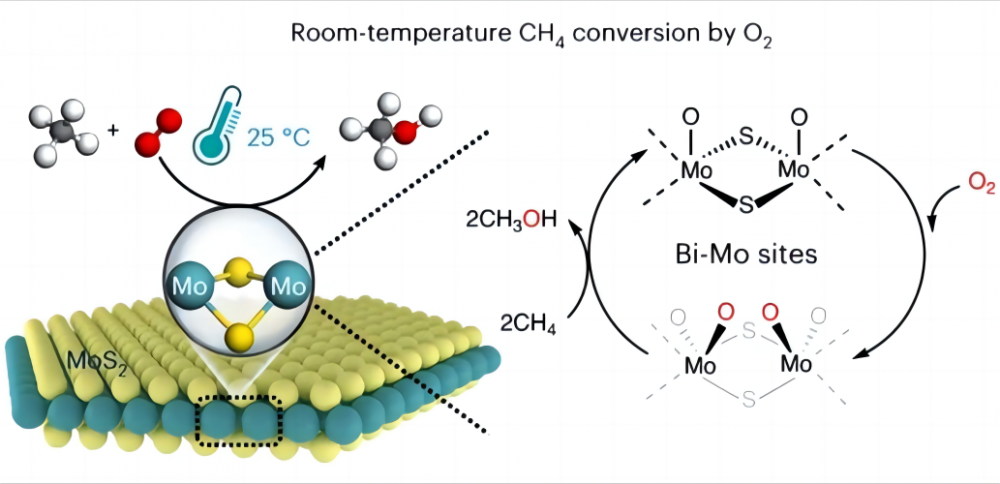
3. signification stratégique significative de l'activation à basse température du méthane Réaliser la conversion catalytique directe du méthane et de l'oxygène à température ambiante et convertissant le méthane dans le gaz naturel en autres produits chimiques utiles, peut considérablement améliorer le taux d'utilisation du gaz naturel, réduire les déchets et mieux protéger l'environnement et réaliser le développement durable de l'énergie . Deuxièmement, en tant que gaz à effet de serre, le méthane est le deuxième après le dioxyde de carbone dans sa contribution au réchauffement climatique. Si le méthane peut être converti en autres substances, il peut nous aider à réduire les émissions de polluants atmosphériques (par exemple, les oxydes de carbone, les oxydes d'azote, les oxydes de soufre, les hydrocarbures et les composés éther) et faciliter la pression du réchauffement climatique.




